疫学
小細胞肺癌は悪性度の高い神経内分泌腫瘍であり、増殖速度が早いため早期に転移・増悪しやすく、予後不良な疾患です1)。小細胞肺癌の約70%は治癒困難な進展型小細胞肺癌であり、多くが治療から1年以内に再発し1)、5年生存率はⅣ期で1.7%と報告されています2)。
小細胞肺癌の予後は不良です(海外データ)
二次治療以降の選択肢は限られており、奏効期間中央値は3.5~5.3ヵ月3-5)、全生存期間(OS)中央値は二次治療で7.00ヵ月、三次治療で5.95ヵ月でした(図1)。また2001年以降、小細胞肺癌の予後は改善が見られませんでした(図2)。
図1
小細胞肺癌治療開始からの全生存期間(海外データ)6)
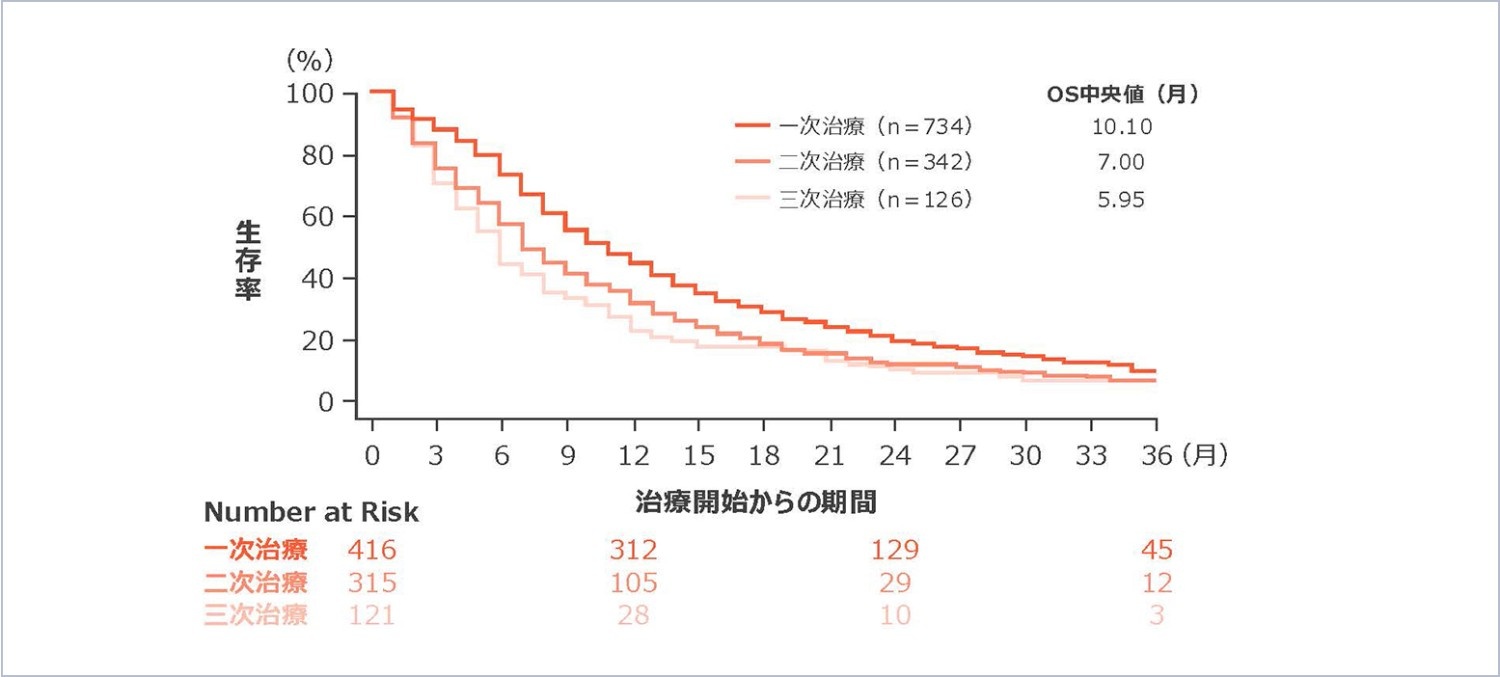
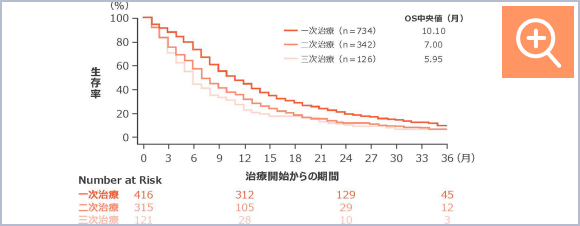
【試験デザイン】
多施設国際非介入研究
【対象】
19ヵ国の56施設において2008年2月~2017年2月の間にデータを収集された小細胞肺癌患者1,073例
【方法】
生存曲線は、Kaplan-Meier法を使用して、各治療ラインごとに作成した。全生存期間は、SCLC診断から死亡日又は連絡可能な最後の接触日までの期間として定義された。各治療ライン別の全生存期間は、治療開始から死亡又は最後の接触日までの期間として定義された。治療ライン別の群は相互に排他的でなかった(一次治療のグループには二次治療を受け続けた患者が含まれ、二次治療のグループには三次治療を受け続けた患者が含まれた)。全生存期間中央値は、治療又は生検のいずれか早い方の開始前の生存時間の左切断を考慮し、遅延参加モデルを使用して生成された。
図2
肺癌における2年生存率の年次推移(海外データ)7)
図2
肺癌における2年生存率の年次推移
(海外データ)7)
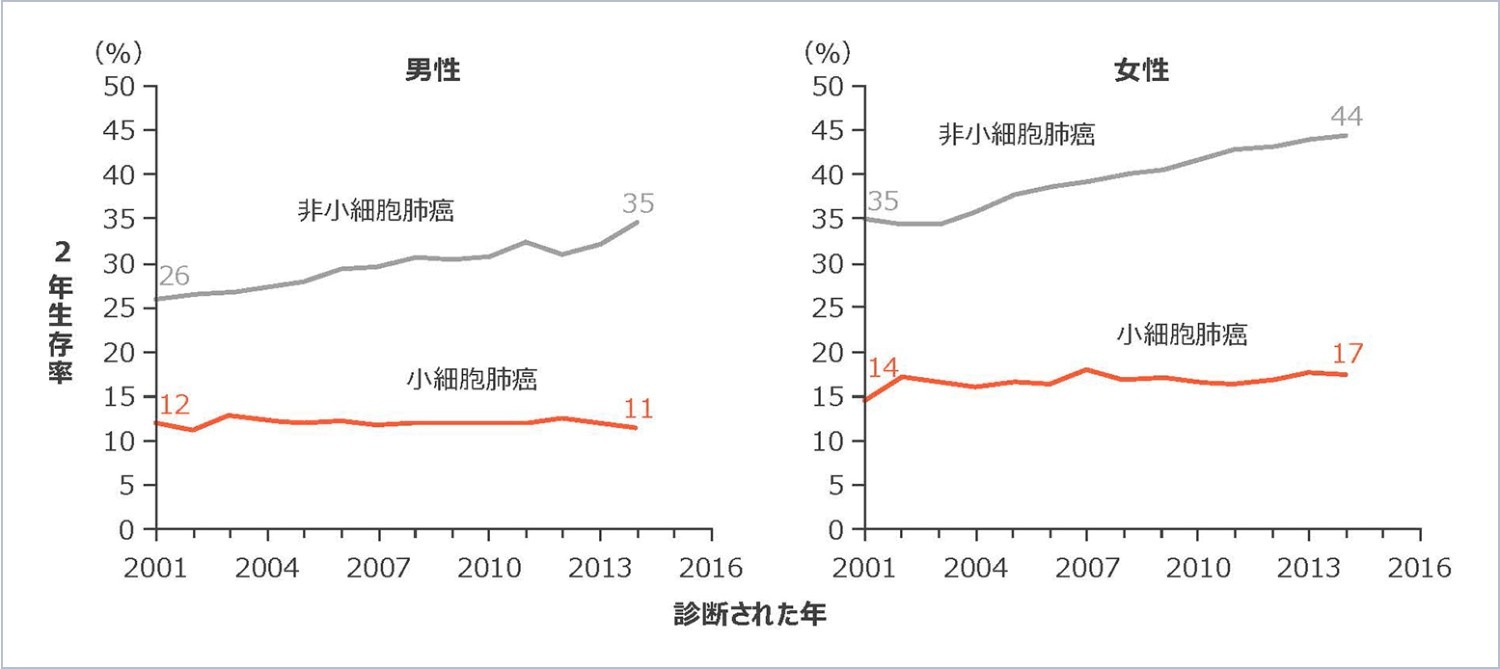
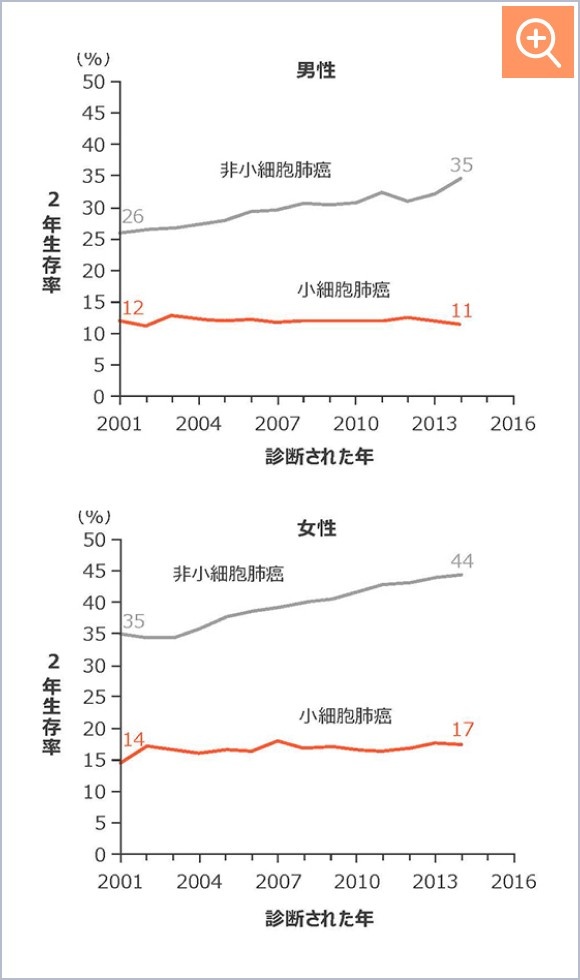
Howlader N, et al. N Engl J Med. 2020; 383(7): 640-649.より改変
Howlader N, et al. N Engl J Med. 2020; 383(7): 640-649.
より改変
【対象】
2001~2016年にSEERデータベースに登録された肺癌患者
【方法】
米国のSEERデータベースを使用して、性別、癌のサブタイプ別に肺癌患者の2年相対生存率を評価した。
開発の歴史
進行・再発小細胞肺癌の新規薬剤は、約20年間にわたり開発が進みませんでした
小細胞肺癌の予後改善がみられなかった理由の1つとして、新規薬剤の開発が約20年間進まなかったことが挙げられます。
二次治療は20年近く新規薬剤の登場はなく、三次治療以降は治療法が確立していません。また、一次治療で免疫療法が処方可能になりましたが、さらなる予後の改善が求められています。
図3
開発の歴史8-9)
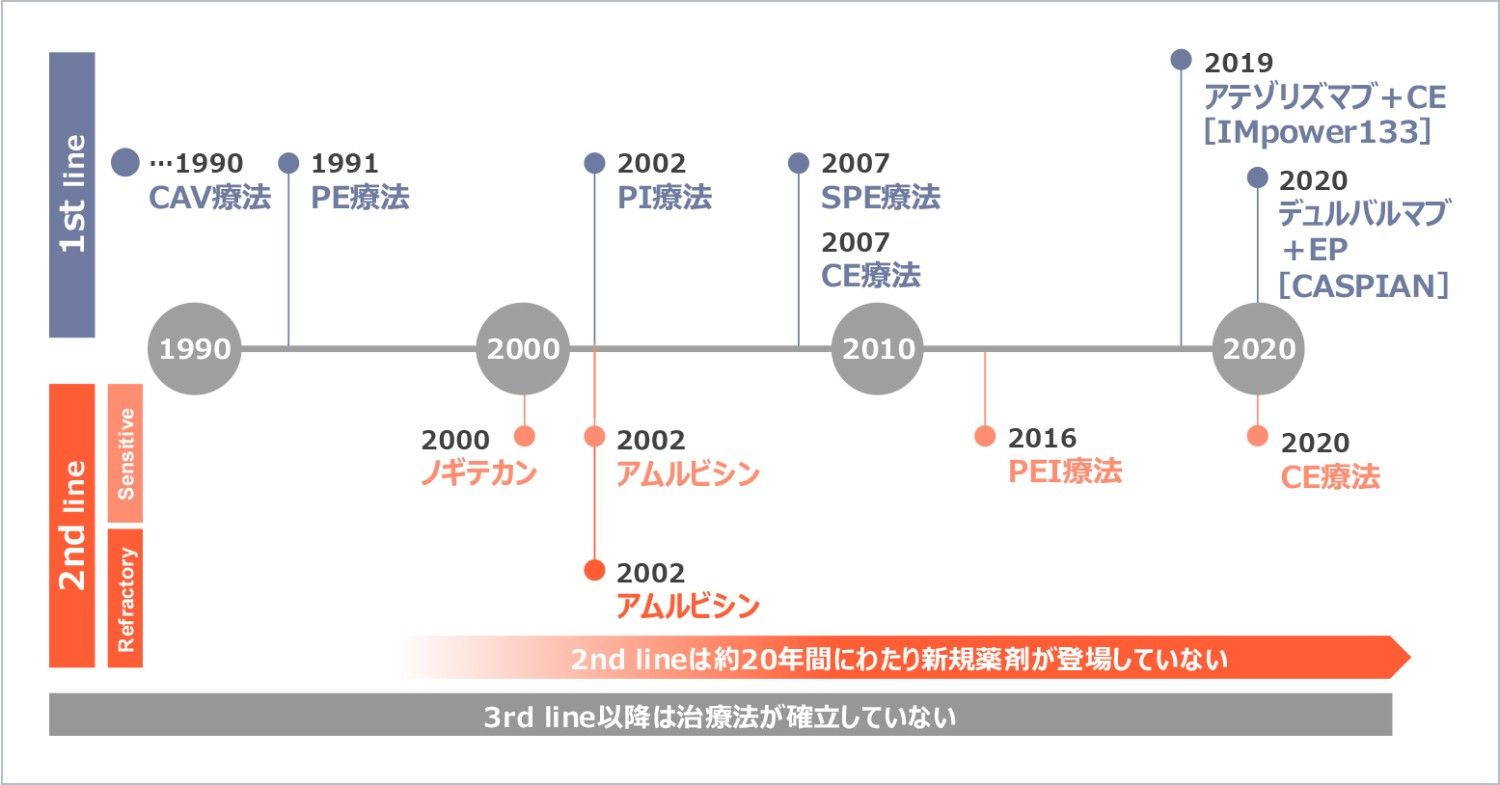
CAV:
シクロホスファミド+ドキソルビシン+ビンクリスチン PE:シスプラチン+エトポシド PI:シスプラチン+イリノテカン
SPE:
分割投与シスプラチン+エトポシド CE:カルボプラチン+エトポシド EP:エトポシド+シスプラチン/カルボプラチン
PEI:
シスプラチン+エトポシド+イリノテカン
病態
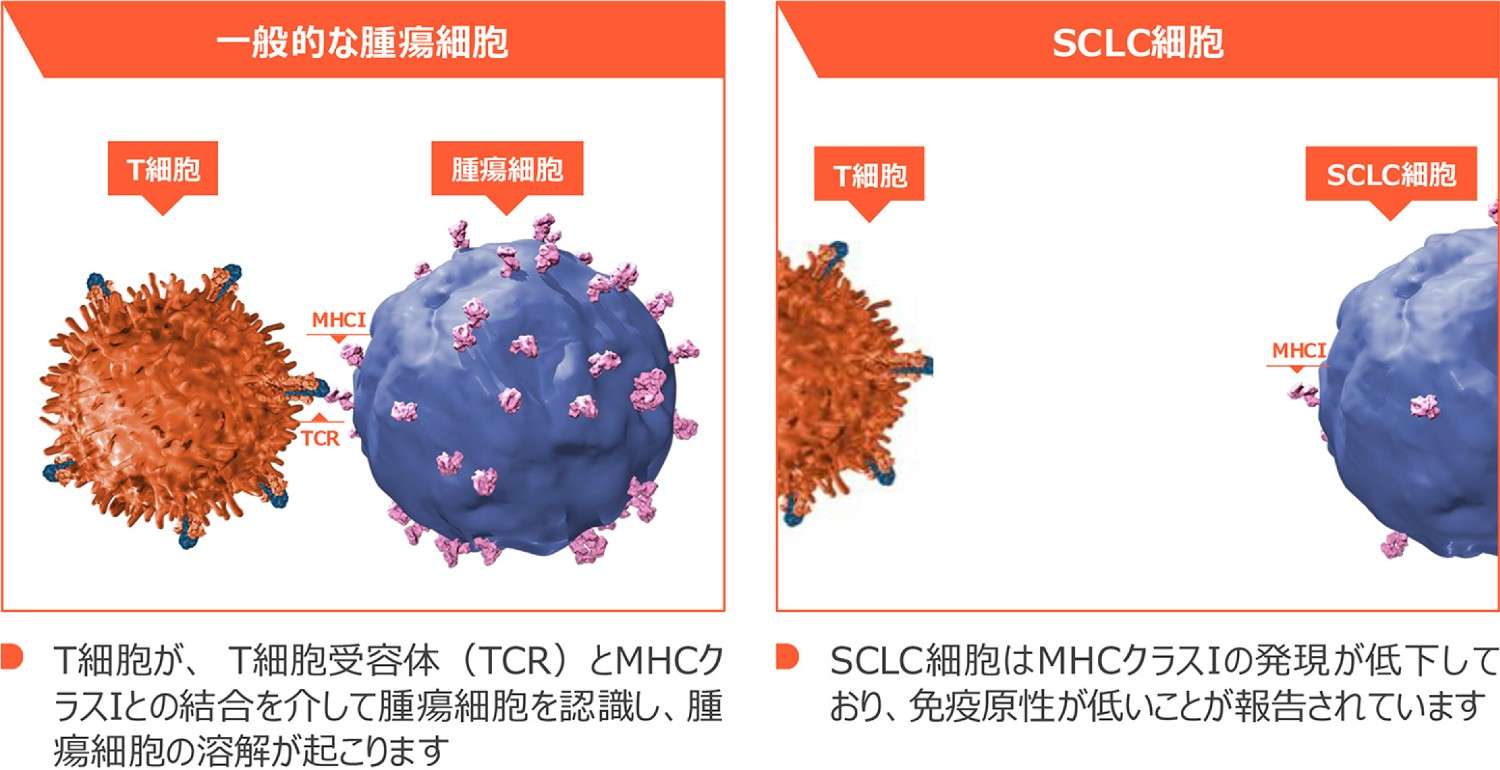
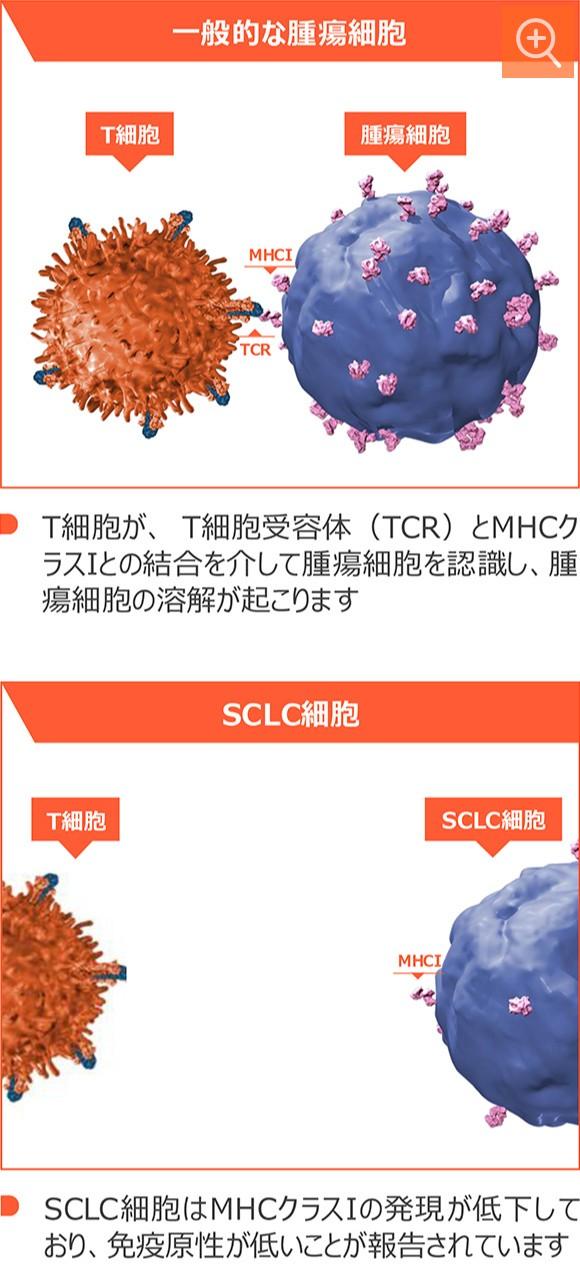
小細胞肺癌はMHCクラスⅠ抗原提示機能が欠損しているため、免疫療法が効きづらいとされていました
小細胞肺癌はMHCクラスIによる抗原提示機構が欠損しており、免疫原性が低いことが報告されています(図4
)。通常、T細胞受容体とMHCクラスⅠとの結合を介してT細胞が腫瘍細胞を認識し、腫瘍細胞の溶解が起こります。しかし、小細胞肺癌ではMHCクラスⅠの発現が低下しており、T細胞による腫瘍細胞の認識が行われないため、免疫原性が低いとされています(図5)。
図4
通常のがん免疫サイクルと、小細胞肺癌の腫瘍微小環境10-11)
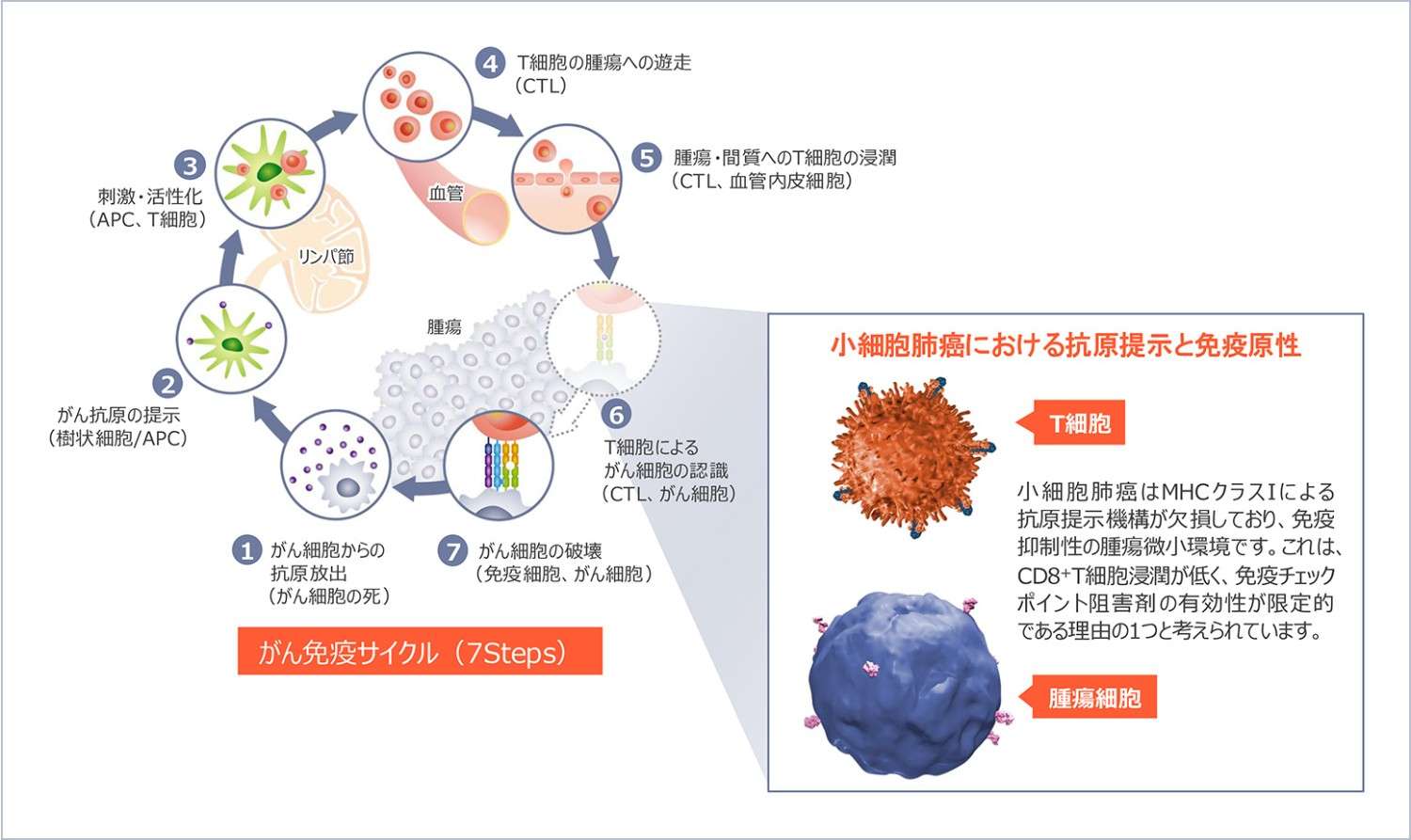
APC:
antigen presenting cell、抗原提示細胞
CTL:
cytotoxic T-lymphocyte、細胞傷害性T細胞�
MHC:
major histocompatibility complex、主要組織適合性複合体
図5
小細胞肺癌におけるMHCクラスⅠの発現低下11-12)
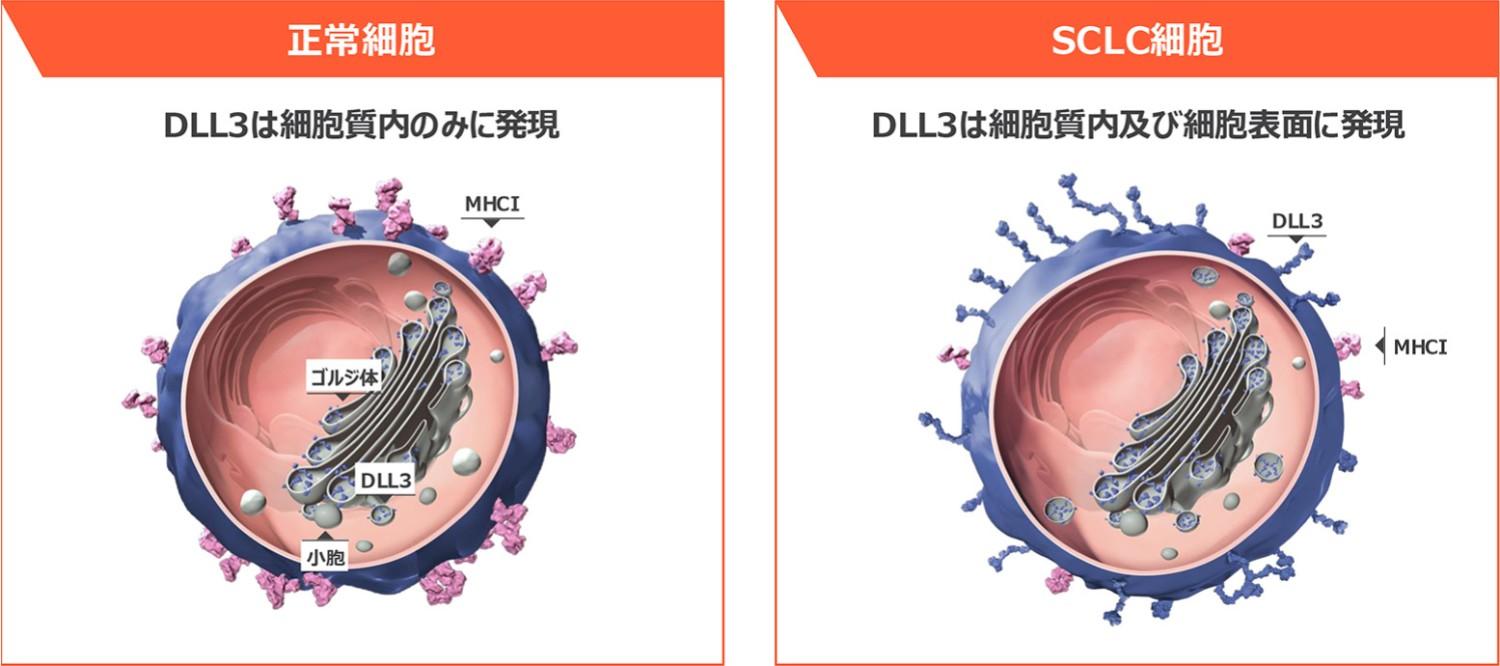
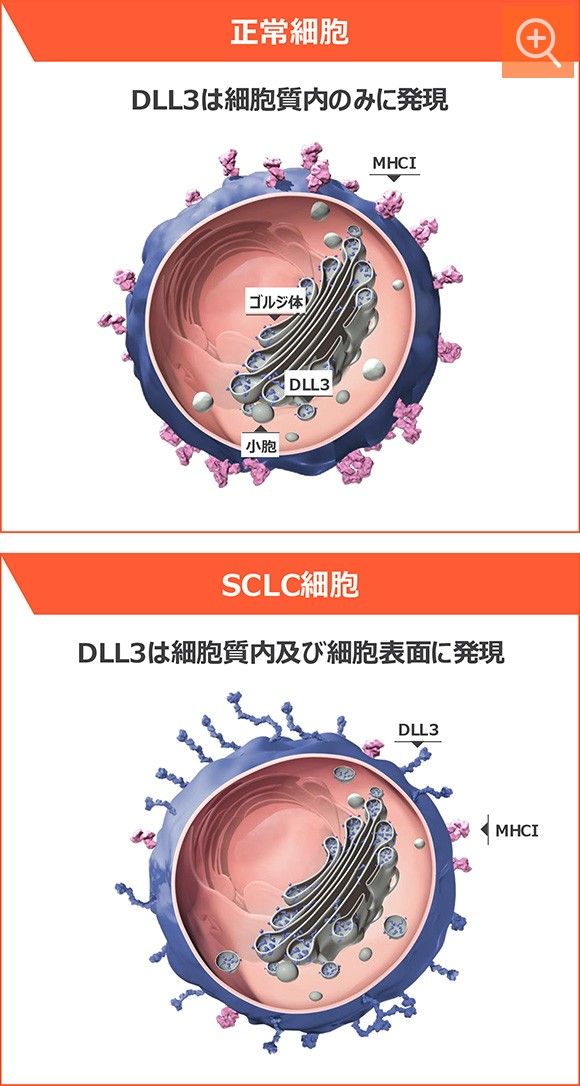
DLL3は小細胞肺癌細胞表面に高発現する腫瘍抗原です
DLL3は、神経内分泌細胞への分化に関与し、小細胞肺癌において腫瘍増殖性に機能することが示唆されています13)。
小細胞肺癌ではDLL3が細胞表面に高発現していますが(小細胞肺癌患者の85%)6,13)、正常細胞では、DLL3は通常ゴルジ体や小胞に存在し、細胞表面にはほとんど存在しません14)。
よってDLL3は小細胞肺癌治療において最適な標的分子として認識されています。
図6
正常細胞とSCLC細胞のDLL3発現6,13-14)
References
1)Rudin CM et al. Nat Rev Dis Primers. 2021; 7: 3.
2)公益財団法人 がん研究振興財団, がんの統計2024. p95
3)von Pawel J, et al. J Clin Oncol. 1999; 17: 658-667.
4)von Pawel J, et al. J Clin Oncol. 2014; 32: 4012-4019.
[利益相反:著者にAmgen社から資金提供を受けた者を含む。]
5)Trigo J, et al. Lancet Oncol. 2020; 21: 645-654.
6)Rojo F, et al. Lung Cancer. 2020; 147: 237-243.
[利益相反:著者にAmgen社から資金提供を受けた者を含む。]
7)Howlader N, et al. N Engl J Med. 2020; 383: 640-649.
8)田村賢太郎ら. 医歯薬出版. 医学のあゆみ. 2023. 287: 515-521.
9)日本肺癌学会編:肺癌診療ガイドライン2024年版. Ⅲ.小細胞肺癌(SCLC).
10)Chen DS, Mellman I. Immunity. 2013; 39: 1-10.
11)Chen Y, et al. Cancer Treat Rev. 2023; 120: 102606.
12)Baeuerle PA, et al. Curr Opin Mol Ther. 2009; 11: 22-30.
13)Sabari JK, et al. Nat Rev Clin Oncol. 2017; 14: 549-561.
14)Leonetti A, et al. Cell Oncol (Dordr). 2019; 42: 261-273.














