

イムデトラについて
臨床成績(有効性 / 安全性)
イムデトラについて
臨床成績(有効性 /
安全性)
有効性1)
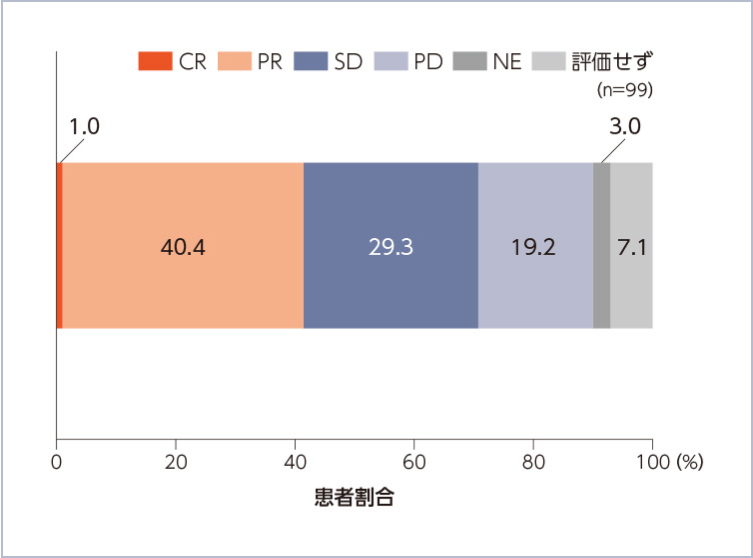
ORR[BICR](主要評価項目)(Part 1及びPart 2:10mg群)(BICR FAS)
ORR[BICR](主要評価項目)
(Part 1及びPart 2:10mg群)
(BICR FAS)
(Part 1及びPart 2:10mg群)
(BICR FAS)
ORRは41.4(97.5% CI:30.3,
53.2)%でした。評価可能な99例のうち、41例に客観的奏効が認められ、CRは1例(1.0%)、PRは40例(40.4%)でした。


データカットオフ日:2023年6月27日
Waterfall Plot[BICR]
腫瘍径和のベースラインからの最良変化率のWaterfall Plotは以下の通りでした。
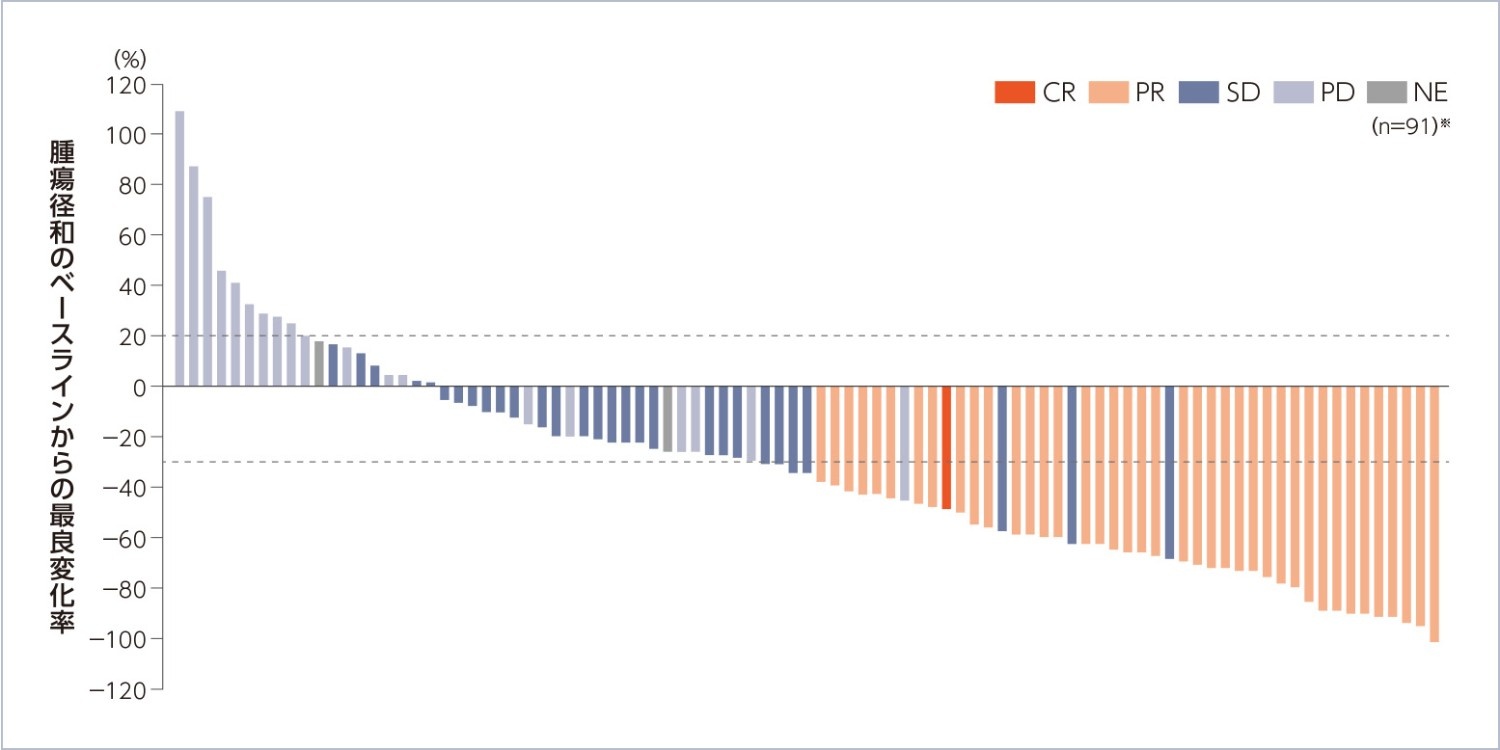


※:標的病変のベースライン後の測定値が評価可能であった91例
データカットオフ日:2023年6月27日
データカットオフ日:2023年6月27日
DOR[BICR](副次評価項目)(Part 1及びPart 2:10mg群)(BICR FAS)
DOR[BICR](副次評価項目)
(Part 1及びPart 2:10mg群)
(BICR FAS)
(Part 1及びPart 2:10mg群)
(BICR FAS)
奏効例41例のDOR中央値は未達(95%CI:5.9,
推定不能)でした。6ヵ月及び12ヵ月時点の奏効持続率は64.9%(95%CI:47.9,
77.5)及び50.8%(95%CI:33.0, 66.1)でした。
(Part 1及びPart 2:10mg群)(BICR FAS)](-/media/812596BC32D54D0DB9753A3992A42DA4.ashx?)
(Part 1及びPart 2:10mg群)(BICR FAS)](-/media/812596BC32D54D0DB9753A3992A42DA4.ashx?)

a) Kaplan-Meier法、b)Brookmeyer-Crowley法、c)Kalbfleisch-Prentice法
データカットオフ日:2023年6月27日、フォローアップ期間中央値:8.3ヵ月
データカットオフ日:2023年6月27日、フォローアップ期間中央値:8.3ヵ月
奏効までの期間及び投与期間のswimmer plot[BICR]
奏効例41例の奏効までの期間及び投与期間のswimmer plotは以下の通りでした。
![図:奏効までの期間及び投与期間のSwimmer Plot[BICR]](-/media/8FF281FF4D6C450BB4BB98A0A296FE26.ashx?)
![図:奏効までの期間及び投与期間のSwimmer Plot[BICR]](-/media/8FF281FF4D6C450BB4BB98A0A296FE26.ashx?)

データカットオフ日:2023年6月27日
DCR[BICR]及びDC期間[BICR](副次評価項目)(Part 1及びPart
2:10mg群)(BICR FAS)
DCRは70.7(95%CI:60.7, 79.4)%でした。DC期間中央値は6.9(95%CI:5.4,
8.6)ヵ月でした。
![表:DCR[BICR]及びDC期間[BICR](副次評価項目)(Part 1及びPart 2:10mg群)(BICR FAS)](-/media/E3A9F16FAE6344F1A8639CB05CAE47BA.ashx?)
a)Clopper-Pearson法、b)Kaplan-Meier法、c)Brookmeyer-Crowley法
データカットオフ日:2023年6月27日、フォローアップ期間中央値:9.7ヵ月
データカットオフ日:2023年6月27日、フォローアップ期間中央値:9.7ヵ月
PFS[BICR](副次評価項目)(Part 1及びPart 2:10mg群)(BICR FAS)
PFS中央値は4.3(95%CI:3.0, 5.6)ヵ月でした。
(Part 1及びPart 2:10mg群)(BICR FAS)](-/media/D1ABE0CC1FB849EF9F4185445F9FD4CD.ashx?)
(Part 1及びPart 2:10mg群)(BICR FAS)](-/media/D1ABE0CC1FB849EF9F4185445F9FD4CD.ashx?)

a)Kaplan-Meier法、b)Brookmeyer-Crowley法、c)Kalbfleisch-Prentice法
データカットオフ日:2023年6月27日、フォローアップ期間中央値:9.7ヵ月
データカットオフ日:2023年6月27日、フォローアップ期間中央値:9.7ヵ月
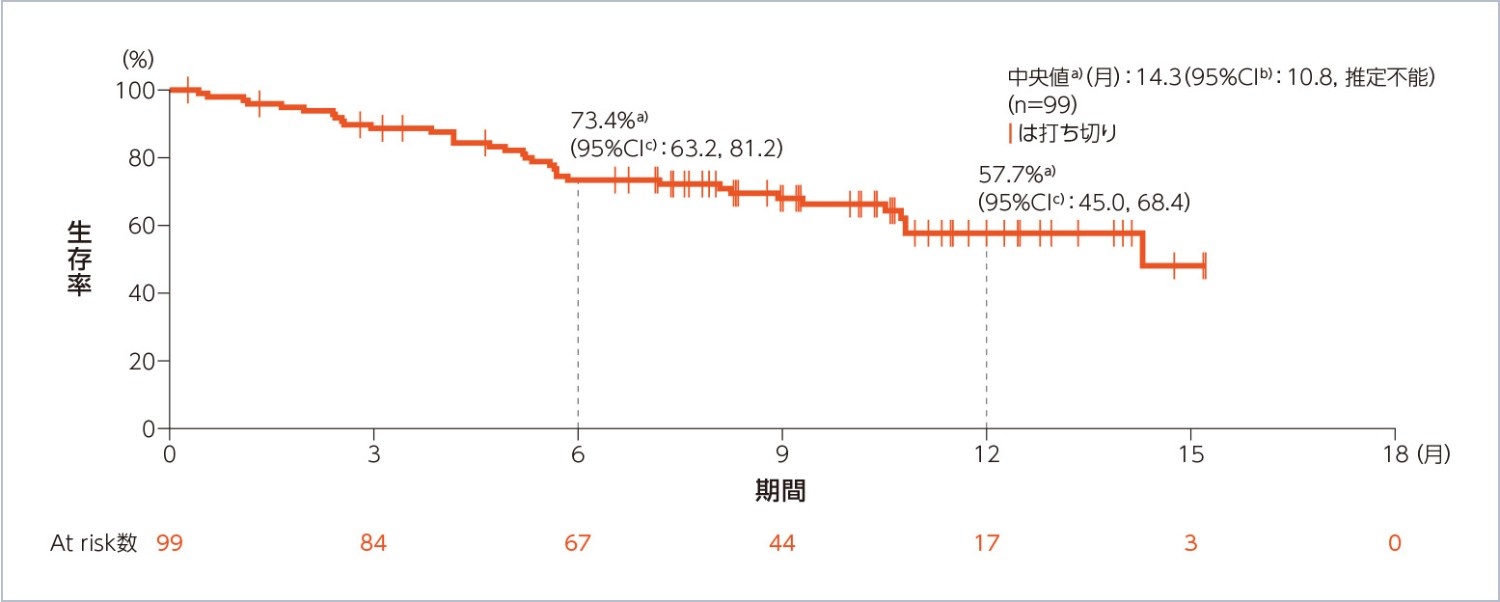
OS(副次評価項目)(Part 1及びPart 2:10mg群)(安全性解析対象集団)
OS中央値は14.3(95%CI:10.8, 推定不能)ヵ月でした。


a) Kaplan-Meier法、b)Brookmeyer-Crowley法、c)Kalbfleisch-Prentice法
データカットオフ日:2023年6月27日、フォローアップ期間中央値:10.6ヵ月
データカットオフ日:2023年6月27日、フォローアップ期間中央値:10.6ヵ月
安全性1,4)
安全性の要約(安全性解析対象集団)
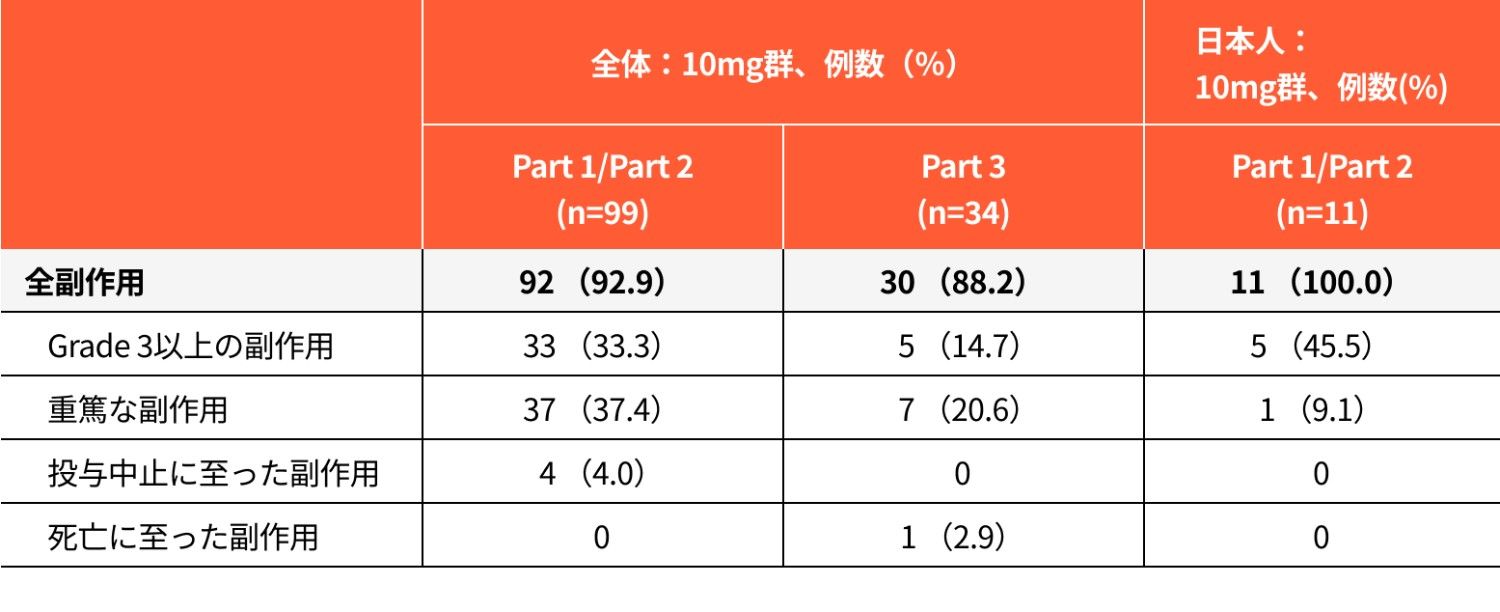
全体
- 副作用はPart 1及びPart 2で99例中92例(92.9%)、Part 3で34例中30例(88.2%)に認められました。主な事象(15%以上)は、Part 1及びPart 2でサイトカイン放出症候群51例(51.5%)、発熱34例(34.3%)、食欲減退24例(24.2%)、味覚不全20例(20.2%)、疲労、貧血各16例(16.2%)、Part 3でサイトカイン放出症候群19例(55.9%)、味覚不全16例(47.1%)、食欲減退11例(32.4%)、発熱9例(26.5%)、疲労、無力症各7例(20.6%)、悪心6例(17.6%)でした。
- 重篤な副作用はPart 1及びPart 2で37例(37.4%)、Part 3で7例(20.6%)に認められました。主な事象(2%以上)は、Part 1及びPart 2でサイトカイン放出症候群26例(26.3%)、発熱4例(4.0%)及び免疫エフェクター細胞関連神経毒性症候群2例(2.0%)、Part 3でサイトカイン放出症候群5例(14.7%)、免疫エフェクター細胞関連神経毒性症候群2例(5.9%)、食欲減退、低カリウム血症、浮動性めまい、神経学的症状、肺臓炎、呼吸不全各1例(2.9%)でした。
- 投与中止に至った副作用はPart 1及びPart 2で4例(4.0%)に認められ、Part 3では認められませんでした。主な事象(1%以上)は、Part 1及びPart 2で貧血、血小板減少症、胆汁うっ滞、腫瘍崩壊症候群、筋力低下、神経毒性、急性腎障害各1例(1.0%)でした。
-
死亡に至った副作用はPart 1及びPart 2では認められず、Part
3で呼吸不全1例(2.9%)が認められました。
日本人
- 副作用はPart 1及びPart 2で11例中11例(100.0%)に認められました。主な事象(15%以上)は、サイトカイン放出症候群8例(72.7%)、発熱、味覚障害各5例(45.5%)、食欲減退、味覚不全、便秘、好中球数減少各3例(27.3%)、アラニンアミノトランスフェラーゼ増加、リンパ球数減少、白血球数減少、発疹各2例(18.2%)でした。
- 重篤な副作用はPart 1及びPart 2でサイトカイン放出症候群1例(9.1%)が認められました。
- 投与中止に至った副作用はPart 1及びPart 2では認められませんでした。
- 死亡に至った副作用はPart 1及びPart 2では認められませんでした。
治験薬との因果関係が否定できない有害事象を副作用とし、有害事象名はMedDRA
ver.26.1を用いてコード化した。CRS及びICANSのGrade分類はASTCTコンセンサス(2019年)に準じた。その他のGrade分類はCTCAE
ver.5.0に準じた。
データカットオフ日:2023年6月27日
注目すべき有害事象:CRSの発現状況(安全性解析対象集団)
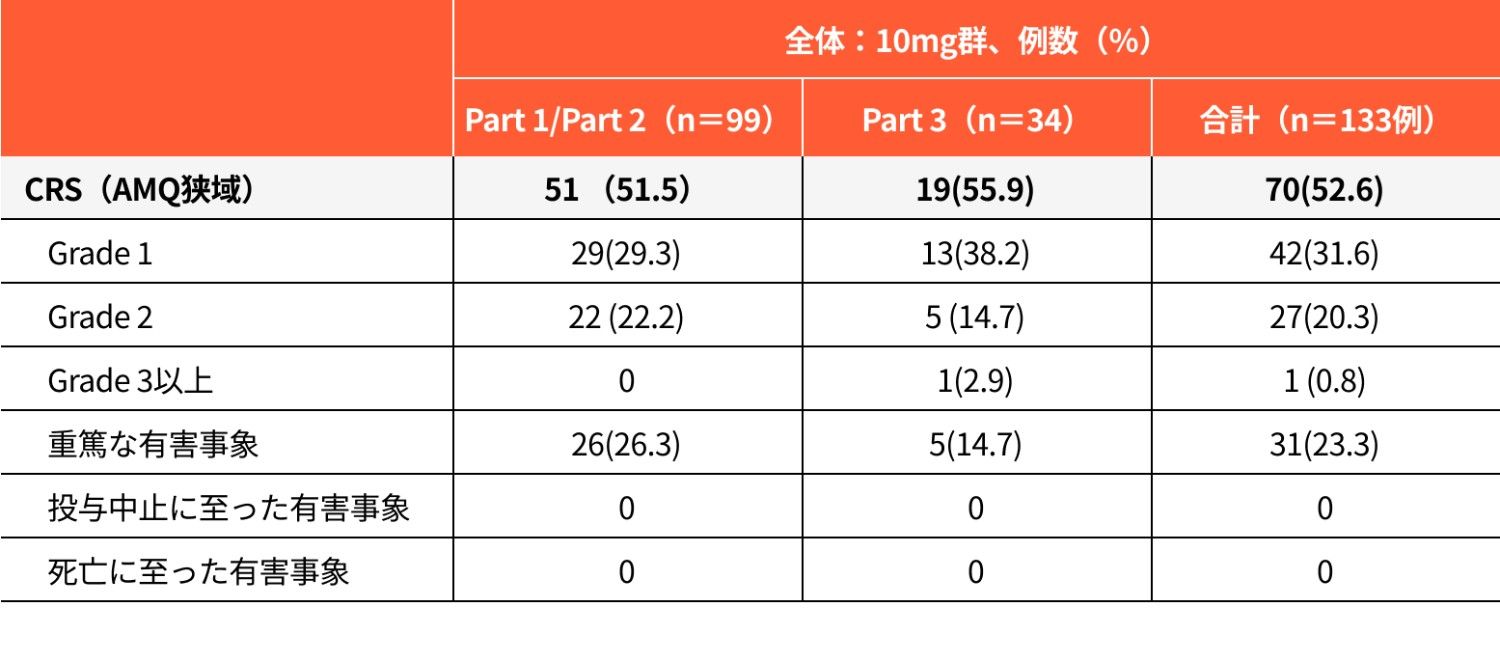
図1CRS(AMQ狭域)の時期別発現率
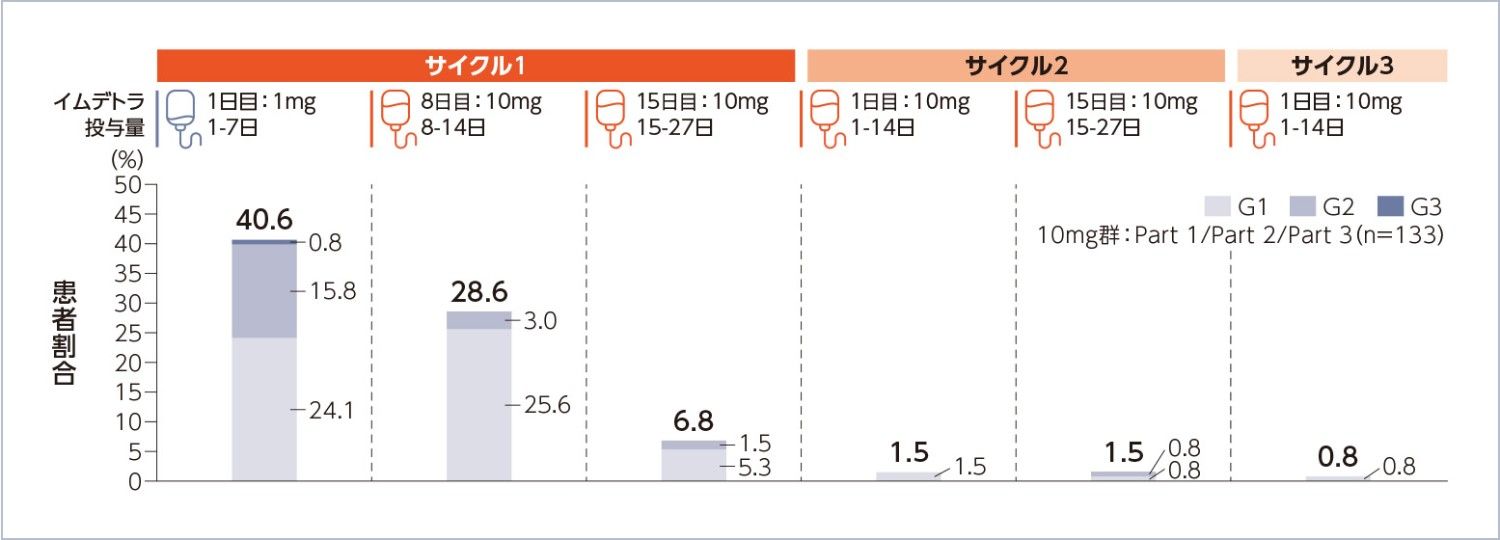


Amgen MedDRA Query:AMQ、Q1:第一四分位数、Q3:第三四分位数
治験薬との因果関係が否定できない有害事象を副作用とし、有害事象名はMedDRA ver.26.1を用いてコード化した。CRS及びICANSのGrade分類は
ASTCTコンセンサス(2019年)に準じた。その他のGrade分類はCTCAE ver.5.0に準じた。
治験薬との因果関係が否定できない有害事象を副作用とし、有害事象名はMedDRA ver.26.1を用いてコード化した。CRS及びICANSのGrade分類は
ASTCTコンセンサス(2019年)に準じた。その他のGrade分類はCTCAE ver.5.0に準じた。
データカットオフ日:2023年6月27日
注目すべき有害事象:神経学的事象(ICANSを含む)の発現状況(安全性解析対象集団)
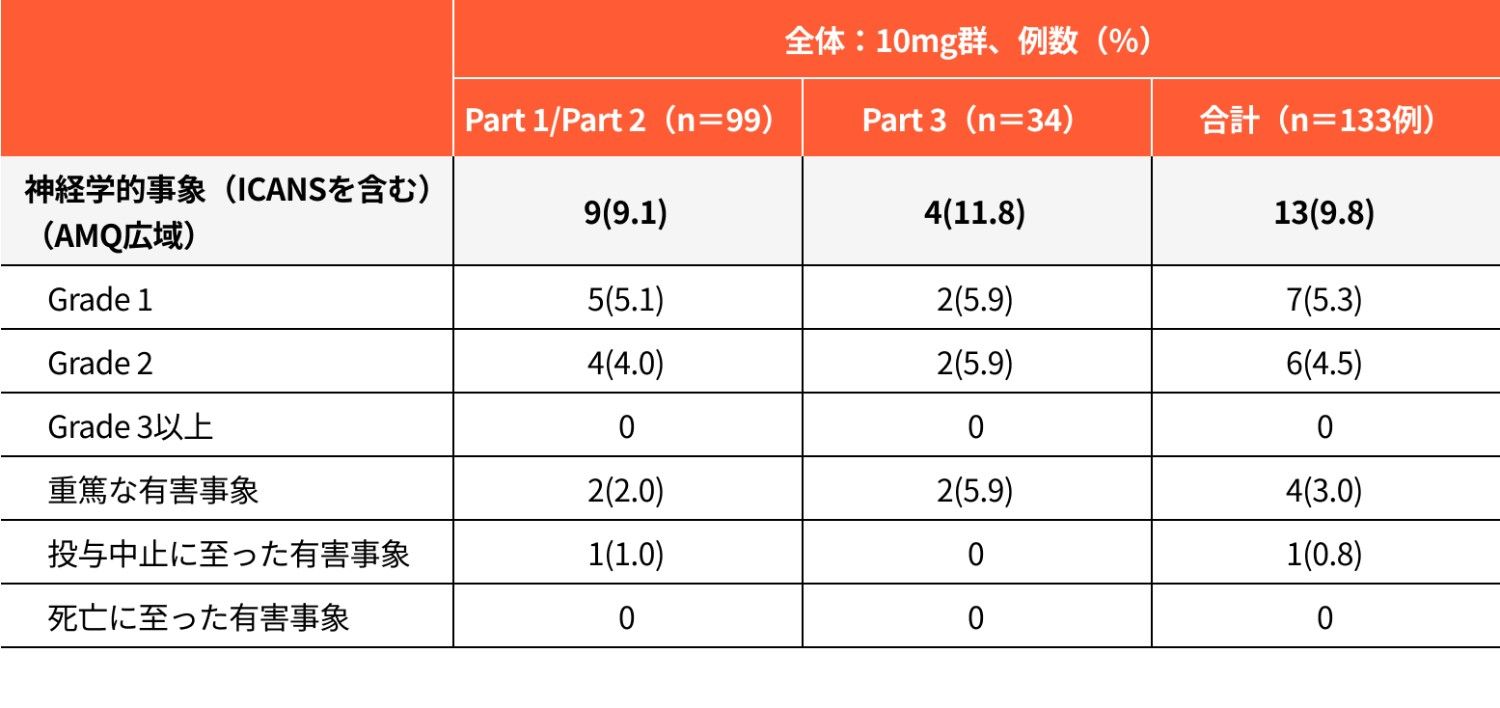
図2
神経学的事象(ICANSを含む)(AMQ広域)の時期別発現率
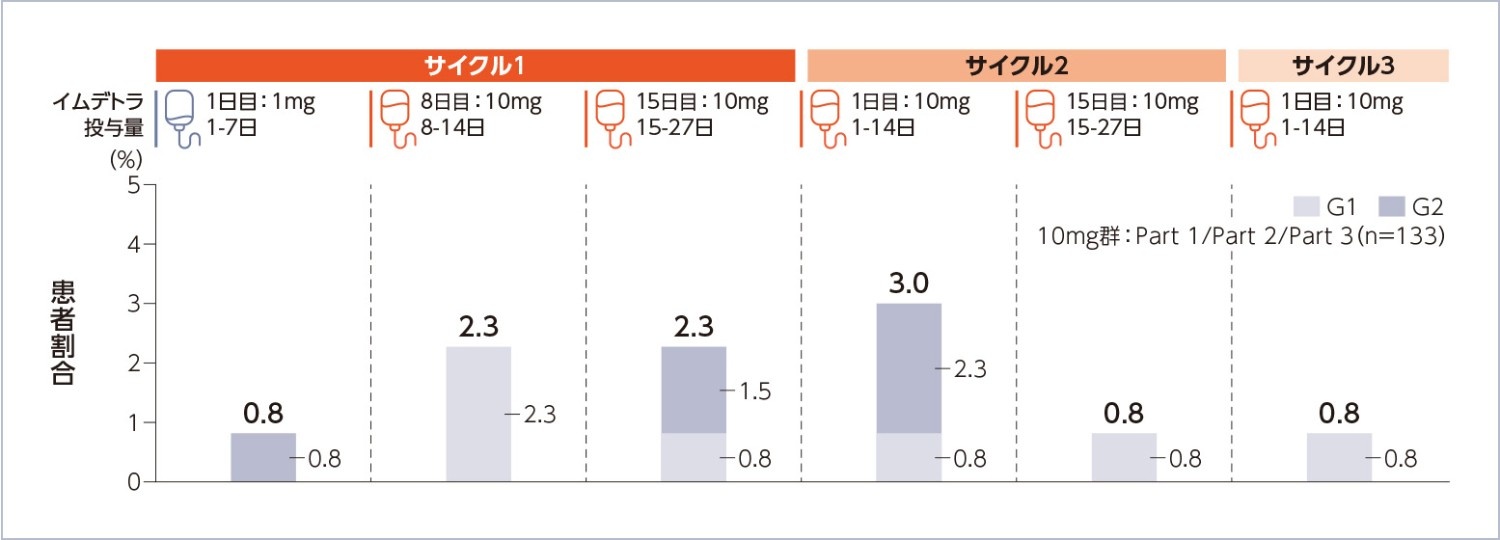


Amgen MedDRA Query:AMQ、Q1:第一四分位数、Q3:第三四分位数
治験薬との因果関係が否定できない有害事象を副作用とし、有害事象名はMedDRA ver.26.1を用いてコード化した。CRS及びICANSのGrade分類は
ASTCTコンセンサス(2019年)に準じた。その他のGrade分類はCTCAE ver.5.0に準じた。
治験薬との因果関係が否定できない有害事象を副作用とし、有害事象名はMedDRA ver.26.1を用いてコード化した。CRS及びICANSのGrade分類は
ASTCTコンセンサス(2019年)に準じた。その他のGrade分類はCTCAE ver.5.0に準じた。
データカットオフ日:2023年6月27日
その他の有害事象(血球減少、間質性肺疾患)の発現状況(安全性解析対象集団)
本解析は事後解析ですが、承認審査過程で評価を受けたためご紹介します。
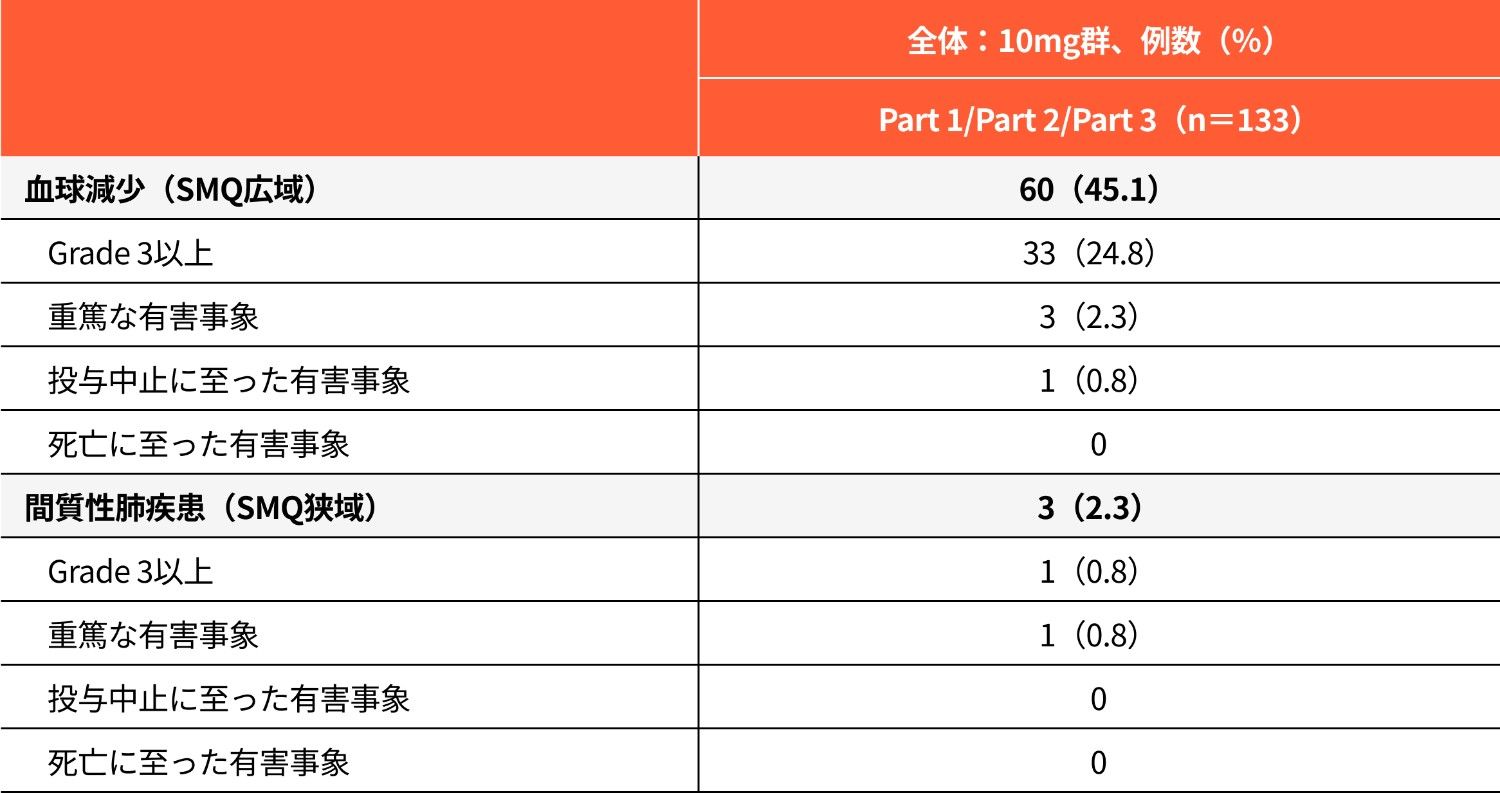
SMQ:MedDRA標準検索式
治験薬との因果関係が否定できない有害事象を副作用とし、有害事象名はMedDRA ver.26.1を用いてコード化した。CRS及びICANSのGrade分類はASTCTコンセンサス(2019年)に準じた。その他のGrade分類はCTCAE ver.5.0に準じた。
データカットオフ日:2023年6月27日
治験薬との因果関係が否定できない有害事象を副作用とし、有害事象名はMedDRA ver.26.1を用いてコード化した。CRS及びICANSのGrade分類はASTCTコンセンサス(2019年)に準じた。その他のGrade分類はCTCAE ver.5.0に準じた。
データカットオフ日:2023年6月27日
DI
2025年4月作成の電子化された添付文書(第3版)に準じて作成
1.警告
1.警告
1.1
本剤は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本剤の使用が適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
1.2
重度のサイトカイン放出症候群及び神経学的事象(免疫エフェクター細胞関連神経毒性症候群を含む)があらわれることがあるので、特に治療初期は入院管理等の適切な体制下で本剤の投与を行うこと。[8.1、11.1.1、11.1.2参照]
1.3
重度のサイトカイン放出症候群があらわれることがあるので、サイトカイン放出症候群に対する前投与薬の投与等の予防的措置を行うとともに、観察を十分に行い、異常が認められた場合には、製造販売業者が提供するサイトカイン放出症候群管理ガイダンス等に従い、適切な処置を行うこと。[7.2、8.2、11.1.1参照]
1.4
重度の神経学的事象(免疫エフェクター細胞関連神経毒性症候群を含む)があらわれることがあるので、観察を十分に行い、異常が認められた場合には、製造販売業者が提供する免疫エフェクター細胞関連神経毒性症候群管理ガイダンス等に従い、適切な処置を行うこと。[8.3、8.4、11.1.2参照]
2.禁忌
2.禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
本剤の成分に対し過敏症の既往歴のある患者
4.効能又は効果
がん化学療法後に増悪した小細胞肺癌
5.効能又は効果に関連する注意
本剤の一次治療及び二次治療における有効性及び安全性は確立していない。
その他の項目を含めた詳細についてはイムデトラの電子添文をご参照ください。
References
1)社内資料:国際共同第Ⅱ相試験(DeLLphi-301試験/20200491試験)(承認時評価資料:
CTD2.7.6.2)
2)Ahn MJ et al. N Engl J Med. 2023; 389: 2063-2075.(TAR00049)
[利益相反:本試験はAmgen社の支援により行われた。]
3)社内資料:日本人部分集団における有効性(TAR90010)(承認時評価資料:CTD2.7.3.3.4)
4)社内資料:日本人部分集団における安全性(TAR90009)(承認時評価資料:CTD2.7.4.5.3)


